1.医療用医薬品の費用対効果評価とは?
2.日本では、どのような医薬品が費用対効果評価制度の対象になるのですか?
3. 諸外国の医療技術評価制度①
4. 諸外国の医療技術評価制度②
5. 日本の費用対効果評価制度の課題
6. 日本の費用対効果評価に対するPhRMAの見解:まとめ
1.医療用医薬品の費用対効果評価とは?
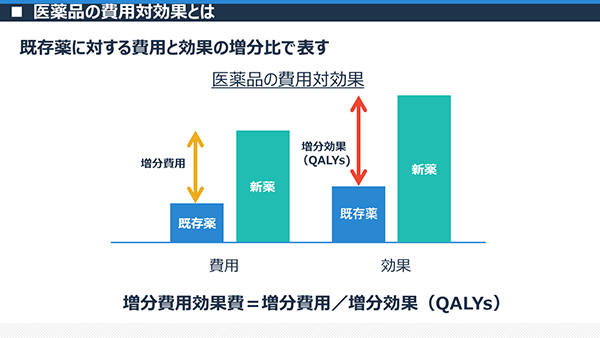
医療用医薬品の費用対効果評価は、厚生労働省によって2019年4月から導入された制度です。日本では、薬価(医療用医薬品の価格)は厚生労働省によってさまざまな要素を考慮し決定されますが、この度導入された本制度によって、一部の医療用医薬品の薬価については、一度価格が決定された後に、費用対効果評価の結果によって価格が調整されることになりました。 一般的に、費用対効果という用語はコストパフォーマンスと同じような意味に捉えられることが多いですが、本制度による医薬品の費用対効果評価は意味が異なります。 医薬品の費用対効果は、新薬(新しい医薬品)と、既存の標準薬(それまでに使用されていた医薬品)の効果と費用を比較することによって評価されます。既存薬と比較して、新薬の効果がどれくらい増加し、それに応じて費用がどれくらい増加したかを比で表します(図1)。その際に、QALY(質調整生存年)という効果のものさしを使います。治療が生み出すQALYは「QOL(quality of life)」を「生存年数」にかけることで求められます。 医薬品の費用対効果の増分は、このQALY(効果)と費用について、それぞれの増加分の比をとったものです。図1
費用対効果では医療用医薬品のどのような価値が評価されるのでしょうか?
まず医療用医薬品の価値とは、どのようなものでしょうか。 医薬品の価値には、臨床的な価値すなわち有効性と安全性が含まれます。この他にも、患者さんの生活の質を改善したり、労働生産性を改善したり、介護者の負担を軽減するなど、社会的な価値などもあります。また技術の進歩に伴い、それまで何回も注射を打たなければならなかった治療が、飲み薬でよくなったり服用回数が減るなどの利便性といった価値もあります。 では、費用対効果評価では、どのような指標を医薬品の価値として評価するのでしょうか。 まず、製薬企業は医薬品の製造販売承認を得るために臨床試験を実施します。臨床試験では薬の有効性や安全性が評価され、その結果が厳しい基準をクリアした場合に製造販売承認を取得することができます。費用対効果評価では、臨床試験によって得られた有効性や安全性のデータを使用して、その医薬品の有効性や安全性が、患者さんの「生活の質」や「長生き」にどれぐらい影響するかという観点で再評価します。多くの場合、患者さんの生活の質に関する評価については、専用に開発され世界各国で使用されているアンケートを用いて評価されます。一方、医薬品にはこのアンケートで評価することができない多くの価値、例えば先に挙げたような社会的価値などがあることも認識されており、世界各国で適切な指標に関する研究や議論が行われています。2.日本では、どのような医薬品が費用対効果評価制度の対象になるのですか?
日本では、薬価はさまざまな要素を考慮して厚生労働省によって決められています。既存薬と同じぐらいの有効性や安全性を有する新薬は、基本的には既存薬と同じぐらいの薬価となります。一方、新しい作用機序、高い有効性・安全性、疾病の治療方法の改善が認められる場合は既存薬よりも高い薬価となります。 日本の費用対効果評価制度では、革新性が高く財政的影響が大きな医薬品が対象になります。対象になった医薬品は一度薬価が決定されてから、費用対効果が評価され、その結果によって薬価が調整される仕組みです(図2)。 なお、費用対効果の結果によって新薬を公的医療保険で負担するかどうかを判断している国もあります。これについては後述します。図2

3. 諸外国の医療技術評価制度①
日本以外のいくつかの欧州やアジア諸国でも、費用対効果評価が取り入れられています。しかし、ほとんどの国では、“医療技術評価(HTA:Health Technology Assessment)”と呼ばれ、費用対効果の結果(例:費用/QALY)だけでなく、患者さんからの要望や疾患の重篤度など、さまざまな要素が考慮されています。そして評価の結果は、その医薬品を税金や公的医療保険で負担する対象にするかどうか、もし公的・私的医療保険で負担するのであれば価格はいくらであれば適正なのか、ということを判断しています。一方で、いくつかの国、例えばドイツでは、費用対効果(費用/QALY)は用いられておらず、フランスでも費用対効果(費用/QALY)は一定のケースでのみ使用されています。 表1| 日本 | アメリカ | イギリス | オーストラリア | |
|---|---|---|---|---|
| HTA機関 | Core2Health(C2H) 国立保健医療科学院 保健医療経済評価研究センター | N/A | National Institute for Health and Care Excellence (NICE) Scottish Medicines Council (SMC) | Pharmaceutical Benefits Advisory Committee (PBAC) |
| 設立年 | 2019 | N/A | 1990 (NICE) 2010 (SMC) | 1953 |
| 評価方法 | 費用対効果分析 | N/A | 費用対効果分析 | 費用対効果分析 |
| 評価結果の使用用途 | 価格調整 | N/A | 保険償還判断、 価格交渉 | 保険償還判断、 価格交渉 |
| カナダ | フランス | ドイツ | 韓国 | |
|---|---|---|---|---|
| HTA機関 | Canadian Agency for Drugs and Technologies in Health (CADTH) | Haute Autorité de Santé (HAS) | Institute for Quality and Efficiency in Healthcare (IQWiG) | Health Insurance Review & Assessment Service (HIRA) |
| 設立年 | 1989 | 2004 | 2004 | 2000 |
| 評価方法 | 費用対効果分析 | 臨床的効果評価 *いくつかのケースでは費用対効果評価も 考慮 | 臨床的効果評価 | 費用対効果分析 |
| 評価結果の使用用途 | 保険償還判断、 価格交渉 | 価格交渉 | 価格交渉 | 保険償還判断、 価格交渉 |
4. 諸外国の医療技術評価制度②
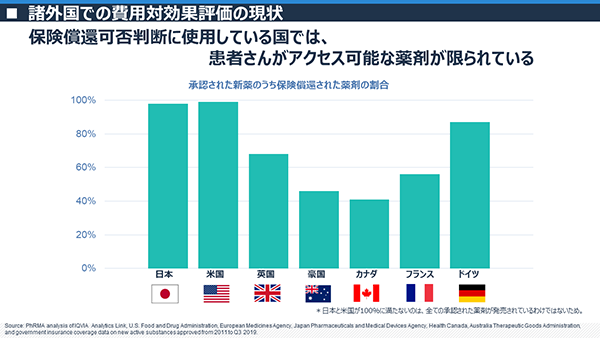
諸外国では、医薬品が承認されてから実際に医師の処方が可能になるまでに日本よりも長い期間を要することが多く、イギリス、オーストラリア、カナダ、フランスなどは平均すると1年以上もかかっています(図3)。またそれだけではなく、評価の結果によっては公的・私的医療保険での負担の対象にならない場合もあります。もし、公的・私的医療保険で負担されない医薬品を使用する場合は、患者さん自身が全額を自費で支払わなくてはならないことになります。 図4で示すとおり、オーストラリアやカナダでは、製造販売承認されても、約半数しか公的医療保険の負担対象となりません。図3
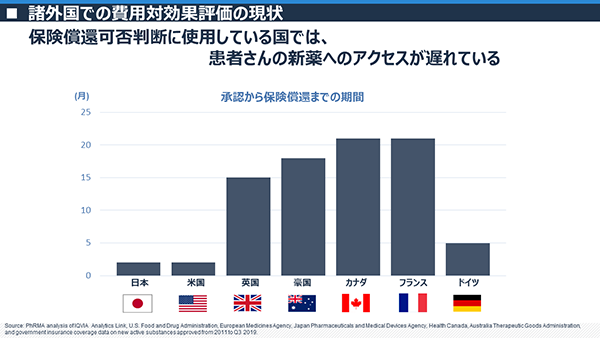
図4
5. 日本の費用対効果評価制度の課題
日本では少子高齢化が進み医療費の伸長が懸念されています。さらに医療技術の進歩により高額な薬剤が出現するなど、医療の高度化も医療費の増加に拍車をかけるのではないかという懸念もあります。日本では医療費を抑制する施策の一つとして、費用対効果評価制度が導入されました。しかし、医薬品の費用対効果評価によって日本の医療費を削減できるかどうかの検証はされていません。先に解説したとおり、現在の費用対効果評価制度で用いられている評価方法では、医薬品のもつ多面的な価値の一部しか評価することができません。医薬品の価値を適切に評価し、優れた医薬品への早期のアクセスを確保するためには、現在の薬価制度を継続していくことが望まれます。そのためには、国民の声を本制度に反映させ、良い制度にしていく必要があります。 日本の制度はまだ開始されたばかりです。医薬品の価値を正しく評価し、医薬品を必要としている患者さんに確実に届けられるように一緒に考えていきましょう。6. 日本の費用対効果評価に対するPhRMAの見解:まとめ
- 患者さんが画期的新薬によってできるだけ早く治療を受けられる、現在の保険償還の仕組みの良い点を守るため、費用対効果評価を新薬を保険償還するかの判断に用いない。
- 費用対効果評価は、今まで通り、医薬品の価値の一部を評価するために薬価制度のなかで補足的に用いる。
- 倫理的・社会的な価値など、数値やICER(増分費用効果費)で表せない医薬品の価値も、できる限り多面的に評価する。
- 費用対効果評価を含む医薬品の総合的評価についての、議論の透明性を確保する。
1.医薬品の費用対効果評価とは?
2.日本の費用対効果評価制度
3. 諸外国の医療技術評価制度①
4. 諸外国の医療技術評価制度②
5. 日本の費用対効果評価制度の課題
6. 日本の費用対効果評価に対するPhRMAの見解:まとめ
